锂离子电池正极材料需要纯度较高的硫酸锰,目前工业硫酸锰中杂质(钙、镁、铁等)含量高,利用下图流程可制取纯度较高的硫酸锰溶液。
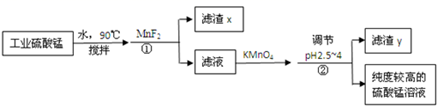
反应①使杂质生成氟化物的沉淀,对反应①前后的杂质含量检测结果(以350g/LMnSO4计)如下:
| 杂质 | 净化前/g | 净化后/g | 去除率/% |
| Fe2+、Fe3+ | 0.001275 | 0.001275 | ﹣ |
| Ca2+ | 0.490000 | 0.021510 | 95.61 |
| Mg2+ | 0.252000 | 0.025100 | 90.04 |
(1)滤渣x中含有的物质是_____。
(2)试分析钙镁去除结果不同的原因:_____。
(3)在滤液中加入KMnO4可以将Fe2+氧化为Fe3+,同时生成Mn2+.该反应的离子方程式为_____。
(4)已知:生成氢氧化物沉淀的pH
| Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | |
| 开始沉淀时 | 6.3 | 1.5 | 8.3 |
| 完全沉淀时 | 8.3 | 2.8 | 9.8 |
注:金属离子的起始浓度为0.1mol/L
根据表中数据解释流程中②的目的:_____。
(5)进一步研究表明,如果反应①后不过滤直接加入KMnO4,同时控制加入的量,反应后调节pH,然后再过滤,可以进一步提高钙镁的去除率.对钙镁去除率提高的原因有如下假设:
假设I:Fe2+与生成了Fe3+,Fe3+水解生成的Fe(OH)3吸附了沉淀物;
假设II:Mn2+与反应生成的活性MnO2吸附了沉淀物。
选择适当的无机试剂,设计实验验证假设是否成立____________________。
(6)锂离子电池充放电过程中,锂离子在正极和负极之间来回移动,就像一把摇椅,称“摇椅式电池”。典型的锂离子电池工作原理如图所示。
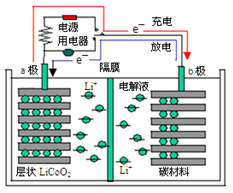
①放电时Li+的移动方向从__________极到极_____(填“a”或“b”)。
②已知电极总反应:LiCoO2+C![]() Li1﹣xCoO2+CLix,写出放电时正极的电极反应式__。
Li1﹣xCoO2+CLix,写出放电时正极的电极反应式__。
答案
CaF2、MgF2 CaF2比MgF2更难溶 ![]() +5Fe2++8H+=5Fe3++Mn2++4H2O 将Fe3+转化为Fe(OH)3达到分离铁元素与锰元素的目的 取工业硫酸锰废水,加入MnF2,将所得样品分成两份,其中一份加入Fe(OH)3胶体,另一份加入活性MnO2,分别检测Ca2+、Mg2+的去除率,若去除率提高(大于95.61%、90.04%),则说明假设成立 b a Li1﹣xCoO2+xLi++xe-=LiCoO2
+5Fe2++8H+=5Fe3++Mn2++4H2O 将Fe3+转化为Fe(OH)3达到分离铁元素与锰元素的目的 取工业硫酸锰废水,加入MnF2,将所得样品分成两份,其中一份加入Fe(OH)3胶体,另一份加入活性MnO2,分别检测Ca2+、Mg2+的去除率,若去除率提高(大于95.61%、90.04%),则说明假设成立 b a Li1﹣xCoO2+xLi++xe-=LiCoO2
【分析】
工业硫酸锰中杂质(钙、镁、铁等)含量高,90°C加入水中搅拌,加入MnF2反应生成CaF2、MgF2沉淀,滤液中加入高锰酸钾溶液氧化亚铁离子生成铁离子,调节溶液pH除去铁离子分离铁离子和锰离子,滤渣y为氢氧化铁。
【详解】
(1)滤渣x中含有的物质是:CaF2、MgF2,
(2)根据表格可以看出,钙去除得较多,钙镁去除结果不同的原因是CaF2比MgF2更难溶;
(3)在滤液中加入KMnO4可以将Fe2+氧化为Fe3+,同时生成Mn2+,结合电子守恒和电荷守恒、原子守恒配平,该反应的离子方程式为:MnO4﹣+5Fe2++8H+5Fe3++Mn2++4H2O;
(4)根据表中数据,可知流程中②调节溶液pH使铁离子和锰离子分离,其目的是:将Fe3+转化为Fe(OH)3达到分离铁元素与锰元素的目的;
(5)对钙镁去除率提高的原因有如下假设:
假设Ⅰ:Fe2+与生成了Fe3+,Fe3+水解生成的Fe(OH)3吸附了沉淀物;
假设Ⅱ:Mn2+与反应生成的活性MnO2吸附了沉淀物.
设计实验验证假设是否成立:取工业硫酸锰溶液,加入MnF2,将所得样品分成两份,其中一份加入Fe(OH)3胶体,另一份加入活性MnO2,分别检测Ca2+、Mg2+的去除率,若去除率提高(大于95.61%、90.04%),则说明假设成立;
(6)①图中放电过程中电子从b流向a说明b为负极,a为正极,放电时Li+的移动方向从负极到正极即b极移向a电极;
②已知电极总反应:LiCoO2+C![]() Li1﹣xCoO2+CLix,则放电时正极的电极反应式为Li1﹣xCoO2+xLi++xe﹣=LiCoO2。
Li1﹣xCoO2+CLix,则放电时正极的电极反应式为Li1﹣xCoO2+xLi++xe﹣=LiCoO2。



 B
B
 D
D