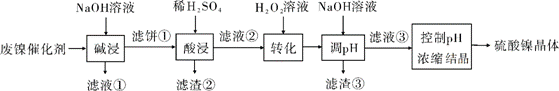
某油脂厂废弃的油脂加氢镍催化剂主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):
溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ |
| 开始沉淀时(c=0.01 mol·L−1)的pH 沉淀完全时(c=1.0×10−5 mol·L−1)的pH | 7.2 8.7 | 3.7 4.7 | 2.2 3.2 | 7.5 9.0 |
回答下列问题:
(1)“碱浸”中NaOH的两个作用分别是______________。为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式______________。
(2)“滤液②”中含有的金属离子是______________。
(3)“转化”中可替代H2O2的物质是______________。若工艺流程改为先“调pH”后“转化”,即
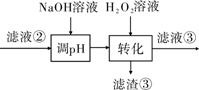
“滤液③”中可能含有的杂质离子为______________。
(4)利用上述表格数据,计算Ni(OH)2的Ksp=______________(列出计算式)。如果“转化”后的溶液中Ni2+浓度为1.0 mol·L−1,则“调pH”应控制的pH范围是______________。
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式______________。
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是______________。
答案
(1). 除去油脂、溶解铝及其氧化物 (2). ![]() +H++H2O=Al(OH)3↓或
+H++H2O=Al(OH)3↓或![]() +H+=Al(OH)3↓+H2O (3). Ni2+、Fe2+、Fe3+ (4). O2或空气 (5). Fe3+ (6).
+H+=Al(OH)3↓+H2O (3). Ni2+、Fe2+、Fe3+ (4). O2或空气 (5). Fe3+ (6). ![]() (7). 3.2~6.2 (8). 2Ni2++ClOˉ+4OHˉ=2NiOOH↓+Clˉ+H2O (9). 提高镍回收率
(7). 3.2~6.2 (8). 2Ni2++ClOˉ+4OHˉ=2NiOOH↓+Clˉ+H2O (9). 提高镍回收率
【解析】
【分析】
由工艺流程分析可得,向废镍催化剂中加入NaOH溶液进行碱浸,可除去油脂,并发生反应2Al+2NaOH+2H2O=2NaAlO2+3H2↑、2Al2O3+4NaOH=4NaAlO2+2H2O将Al及其氧化物溶解,得到的滤液①含有NaAlO2,滤饼①为Ni、Fe及其氧化物和少量其他不溶性杂质,加稀H2SO4酸浸后得到含有Ni2+、Fe2+、Fe3+的滤液②,Fe2+经H2O2氧化为Fe3+后,加入NaOH调节pH使Fe3+转化为Fe(OH)3沉淀除去,再控制pH浓缩结晶得到硫酸镍的晶体,据此分析解答问题。
【详解】(1)根据分析可知,向废镍催化剂中加入NaOH溶液进行碱浸,可除去油脂,并将Al及其氧化物溶解,滤液①中含有NaAlO2(或Na[Al(OH)4]),加入稀硫酸可发生反应![]() +H++H2O=Al(OH)3↓或
+H++H2O=Al(OH)3↓或![]() +H+=Al(OH)3↓+H2O,故答案为:除去油脂、溶解铝及其氧化物;
+H+=Al(OH)3↓+H2O,故答案为:除去油脂、溶解铝及其氧化物;![]() +H++H2O=Al(OH)3↓或
+H++H2O=Al(OH)3↓或![]() +H+=Al(OH)3↓+H2O;
+H+=Al(OH)3↓+H2O;
(2)加入稀硫酸酸浸,Ni、Fe及其氧化物溶解,所以“滤液②”中含有的金属离子是Ni2+、Fe2+、Fe3+,故答案为:Ni2+、Fe2+、Fe3+;
(3)“转化”在H2O2的作用是将Fe2+氧化为Fe3+,可用O2或空气替代;若将工艺流程改为先“调pH”后“转化”,会使调pH过滤后的溶液中含有Fe2+,则滤液③中可能含有转化生成的Fe3+,故答案为:O2或空气;Fe3+;
(4)由上述表格可知,Ni2+完全沉淀时的pH=8.7,此时c(Ni2+)=1.0×10-5mol·L-1,c(H+)=1.0×10-8.7mol·L-1,则c(OH-)=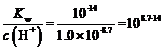 ,则Ni(OH)2的
,则Ni(OH)2的![]() ;或者当Ni2+开始沉淀时pH=7.2,此时c(Ni2+)=0.01mol·L-1,c(H+)=1.0×10-7.2mol·L-1,则c(OH-)=
;或者当Ni2+开始沉淀时pH=7.2,此时c(Ni2+)=0.01mol·L-1,c(H+)=1.0×10-7.2mol·L-1,则c(OH-)=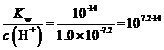 ,则Ni(OH)2的
,则Ni(OH)2的![]() ;如果“转化”后的溶液中Ni2+浓度为1.0mol·L-1,为避免镍离子沉淀,此时
;如果“转化”后的溶液中Ni2+浓度为1.0mol·L-1,为避免镍离子沉淀,此时 ,则
,则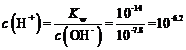 ,即pH=6.2;Fe3+完全沉淀的pH为3.2,因此“调节pH”应控制的pH范围是3.2~6.2,故答案为:
,即pH=6.2;Fe3+完全沉淀的pH为3.2,因此“调节pH”应控制的pH范围是3.2~6.2,故答案为:![]() ;3.2~6.2;
;3.2~6.2;
(5)由题干信息,硫酸镍在强碱中被NaClO氧化得到NiOOH沉淀,即反应中Ni2+被氧化为NiOOH沉淀,ClOˉ被还原为Clˉ,则根据氧化还原得失电子守恒可得离子方程式为2Ni2++ClOˉ+4OHˉ=2NiOOH↓+Clˉ+H2O,故答案为:2Ni2++ClOˉ+4OHˉ=2NiOOH↓+Clˉ+H2O;
(6)分离出硫酸镍晶体后的母液中还含有Ni2+,可将其收集、循环使用,从而提高镍的回收率,故答案为:提高镍的回收率。
【点睛】本题主要考查金属及其化合物的性质、沉淀溶解平衡常数Ksp的计算、氧化还原离子反应方程式的书写等知识点,需要学生具有很好的综合迁移能力,解答关键在于正确分析出工艺流程原理,难点在于Ksp的计算及“调pH”时pH的范围确定。