硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是SO2的催化氧化:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) ΔH=−98 kJ·mol−1。回答下列问题:
SO3(g) ΔH=−98 kJ·mol−1。回答下列问题:
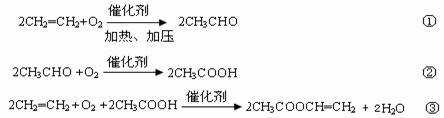
(1)钒催化剂参与反应的能量变化如图所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为:_________。
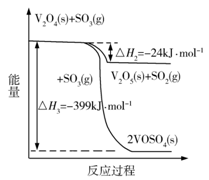
(2)当SO2(g)、O2(g)和N2(g)起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下,SO2平衡转化率α 随温度的变化如图所示。反应在5.0MPa、550℃时的α=__________,判断的依据是__________。影响α的因素有__________。
(3)将组成(物质的量分数)为2m% SO2(g)、m% O2(g)和q% N2(g)的气体通入反应器,在温度t、压强p条件下进行反应。平衡时,若SO2转化率为α,则SO3压强为___________,平衡常数Kp=___________(以分压表示,分压=总压×物质的量分数)。
(4)研究表明,SO2催化氧化的反应速率方程为:v=k(![]() −1)0.8(1−nα')。式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α'为某时刻SO2转化率,n为常数。在α'=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v~t曲线,如图所示。
−1)0.8(1−nα')。式中:k为反应速率常数,随温度t升高而增大;α为SO2平衡转化率,α'为某时刻SO2转化率,n为常数。在α'=0.90时,将一系列温度下的k、α值代入上述速率方程,得到v~t曲线,如图所示。
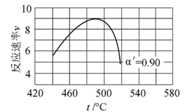
曲线上v最大值所对应温度称为该α'下反应的最适宜温度tm。t<tm时,v逐渐提高;t>tm后,v逐渐下降。原因是__________________________。
答案
(1). 2V2O5(s)+ 2SO2(g)⇌ 2VOSO4(s)+ V2O4(s) ∆H= -351 kJ∙mol-1 (2). 0.975 (3). 该反应气体分子数减少,增大压强,α提高。所以,该反应在550℃、压强为5.0MPa>2.5MPa=p2的,所以p1=5.0MPa (4). 反应物(N2和O2)的起始浓度(组成)、温度、压强 (5). ![]() (6).
(6). 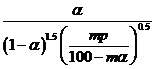 (7). 升高温度,k增大使v逐渐提高,但α降低使v逐渐下降。当t<tm,k增大对v的提高大于α引起的降低;当t>tm,k增大对v的提高小于α引起的降低
(7). 升高温度,k增大使v逐渐提高,但α降低使v逐渐下降。当t<tm,k增大对v的提高大于α引起的降低;当t>tm,k增大对v的提高小于α引起的降低
【解析】
【分析】
根据盖斯定律,用已知的热化学方程式通过一定的数学运算,可以求出目标反应的反应热;根据压强对化学平衡的影响,分析图中数据找到所需要的数据;根据恒压条件下总压不变,求出各组分的分压,进一步可以求出平衡常数;根据题中所给的速率公式,分析温度对速率常数及二氧化硫的转化率的影响,进一步分析对速率的影响。
【详解】(1)由题中信息可知:
①SO2(g)+![]() O2(g)⇌SO3(g) ∆H= -98kJ∙mol-1
O2(g)⇌SO3(g) ∆H= -98kJ∙mol-1
②V2O4(s)+ SO3(g)⇌V2O5(s)+ SO2(g) ∆H2= -24kJ∙mol-1
③V2O4(s)+ 2SO3(g)⇌2VOSO4(s) ∆H1= -399kJ∙mol-1
根据盖斯定律可知,③-②´2得2V2O5(s)+ 2SO2(g)⇌ 2VOSO4(s)+ V2O4(s),则∆H= ∆H1-2∆H2=( -399kJ∙mol-1)-( -24kJ∙mol-1)´2= -351kJ∙mol-1,所以该反应的热化学方程式为:2V2O5(s)+ 2SO2(g)⇌ 2VOSO4(s)+ V2O4(s) ∆H= -351 kJ∙mol-1;
(2) SO2(g)+![]() O2(g)⇌SO3(g),该反应是一个气体分子数减少的放热反应,故增大压强可以使化学平衡向正反应方向移动。因此,在相同温度下,压强越大,SO2的平衡转化率越大,所以,该反应在550℃、压强为5.0MPa条件下,SO2的平衡转化率一定高于相同温度下、压强为2.5MPa的,因此,p1=5.0MPa,由图中数据可知,α=0.975。影响α的因素就是影响化学平衡移动的因素,主要有反应物(N2和O2)的浓度、温度、压强等。
O2(g)⇌SO3(g),该反应是一个气体分子数减少的放热反应,故增大压强可以使化学平衡向正反应方向移动。因此,在相同温度下,压强越大,SO2的平衡转化率越大,所以,该反应在550℃、压强为5.0MPa条件下,SO2的平衡转化率一定高于相同温度下、压强为2.5MPa的,因此,p1=5.0MPa,由图中数据可知,α=0.975。影响α的因素就是影响化学平衡移动的因素,主要有反应物(N2和O2)的浓度、温度、压强等。
(3)假设原气体的物质的量为100mol,则SO2、O2和N2的物质的量分别为2m mol、m mol和q mol,2m+m+q=3m+q=100,SO2的平衡转化率为α,则有下列关系:

平衡时气体的总物质的量为n(总)= 2m(1-α)+m(1-α)+2mαmol+q mol,则SO3的物质的量分数为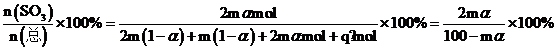 。该反应在恒压容器中进行,因此,SO3的分压p(SO3)=
。该反应在恒压容器中进行,因此,SO3的分压p(SO3)=![]() ,p(SO2)=
,p(SO2)=![]() ,p(O2)=
,p(O2)=![]() ,在该条件下,SO2(g)+
,在该条件下,SO2(g)+ ![]() O2(g)⇌2SO3(g) 的Kp=
O2(g)⇌2SO3(g) 的Kp=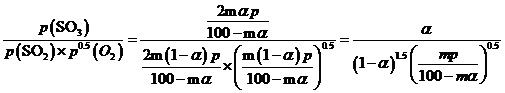 。
。
(4) 由于该反应是放热反应,温度升高后α降低。由题中信息可知,v=![]() ,升高温度,k增大使v逐渐提高,但α降低使v逐渐下降。当t<tm,k增大对v的提高大于α引起的降低;当t>tm,k增大对v的提高小于α引起的降低。
,升高温度,k增大使v逐渐提高,但α降低使v逐渐下降。当t<tm,k增大对v的提高大于α引起的降低;当t>tm,k增大对v的提高小于α引起的降低。
【点睛】本题有关化学平衡常数的计算是一个难点,尤其题中给的都是字母型数据,这无疑增大了难度。这也是对考生的意志的考验,只要巧妙假设、小心求算,还是可以得到正确结果的,毕竟有关化学平衡的计算是一种熟悉的题型。本题的另一难点是最后一问,考查的是速率公式与化学平衡的综合理解,需要明确化学反应速率与速率常数及平衡转化率之间的函数关系,才能作出正确的解答。所以,耐心和细心才是考好的保证。