工业以软锰矿(主要成分是MnO2 。含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:[已知PH=3.7时,Fe3+ 以Fe(OH)3的形式完全沉淀。]
过量 SO2 MnO2 NH4HCO3溶液

滤渣I 滤渣II 滤液
回答下列问题:
(1)为了提高“浸锰”过程中原料的浸出率,可以采取的措施有
(写一条)。
(2)“浸锰”过程中Fe2O3与SO2反应的离子方程式为:
Fe2O3 + SO2 + 2H+ = 2Fe2+ + SO42- + H2O ,该反应是经历以下两步反应实现的。
① Fe2O3 + 6H+ = 2Fe3+ + 3H2O ② ……
写出②的离子方程式: 。
(3)“过滤I”所得溶液中主要存在的两种金属阳离子为
(填离子符号)。
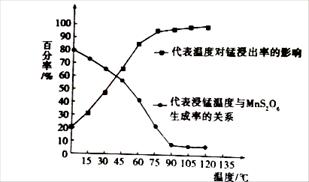
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰” 反
应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是 。
(5)写出“氧化”过程中MnO2与SO2反应的化学方程式:
。
(6)滤渣I是 (填化学式)。
(7)向“过滤II”所得滤液中加入NH4HCO3溶液时温度不宜太高的
原因是 ;
加入NH4HCO3溶液后生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式: 。
答案
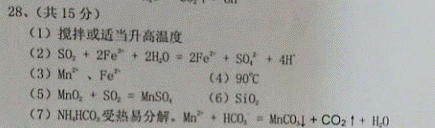

 H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L