回答下列问题:
(1)硫代硫酸钠溶液与氯气能发生反应生成氯化钠、氯化氢和硫酸,则该反应的离子方程式为:;当Na2S2O3过量时,溶液发生的现象是。
(2)已知Fe2+或I2能与H2O2在一定条件下发生下列反应:Fe2+:①H2O2+2Fe2++2H+=2Fe3++2H2O;②H2O2+2Fe3+=2Fe2++2H++O2↑;I2:③H2O2+I2=2HIO;④……。 则方程④为,
Fe2+和I2分别在这两组反应中的作用是。
(3)向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10(忽略溶液的体积变化),请计算:
①完全沉淀后,溶液中c(Ag+)=__________;②完全沉淀后,溶液的pH=__________。
(4)某化工厂产生的废水中含有Fe2+、Mn2+等金属离子,可用过硫酸铵[(NH4)2S2O8]氧化除去。
①过硫酸铵与Mn2+反应生成MnO2的离子方程式为。
②温度与Fe2+、Mn2+氧化程度之间的关系如图1所示:
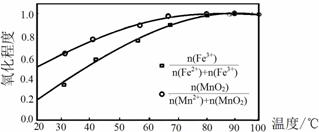
图1
实验过程中应将温度控制在。Fe2+与Mn2+被氧化后形成胶体絮状粒子,常加入活性炭处理,加入活性炭的目的为。
③H2O2也有较强氧化性,在实际生产中不用H2O2氧化Mn2+的原因是
。
答案
(1)S2O32-+4Cl2+![]() 5H2O=8Cl-+2SO42-+10H+
5H2O=8Cl-+2SO42-+10H+
出现浑浊、有刺激性气味的气体(或气泡)产生
(2)2HIO+H2O2=I2+2H2O+O2↑ 催化剂
(3)①1.0×10-7 mol·L-1 ②2
[计算过程:①反应前,n(Ag+)=0.018 mol·L-1×0.05 L=0.9×10-3mol,n(Cl-)=0.020 mol·L-1×0.05 L=1×10-3mol;反应后剩余的n(Cl-)=1×10-3-0.9×10-3mol=1×10-4mol,则混合溶液中c(Cl-)=1×10-4×(100/1000)=1×10-3mol·L-1,c(Ag+)=Ksp(AgCl)/c(Cl-)=1.0×10-7mol·L-1。②H+没有参与反应,完全沉淀后,c(H+)=0.010 mol·L-1,pH=2]
(4)①S2O82-+ 2H2O + Mn 2+=4H++ 2SO42-+ MnO2↓
②80℃(80℃~90℃区间均可)吸附胶体粒子形成沉淀
催化剂
③锰的化合物可催化H2O2的分解,使消耗的H2O2增多

 H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L