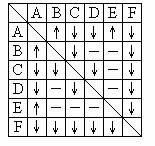
.在图(Ⅰ)所示的装置中,烧杯中盛放的是Ba(OH)2溶液,当从滴定管中逐渐加入某种溶液A时,溶液的导电性的变化趋势如图(Ⅱ)所示。
(Ⅰ)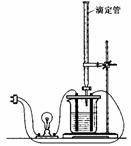 (Ⅱ)
(Ⅱ)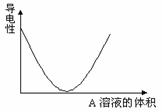
(1)滴加液体至图(Ⅱ)中曲线最低点时,灯泡可能熄灭,可能的原因是______________。
(2)试根据离子反应的特点分析,溶液A中含有的溶质可能是(填序号)____________。
①HCl ②H2SO4 ③NaHSO4 ④NaHCO3
(3)已知0.1mol·L-1NaHSO4溶液中c(H+)=0.1 mol·L-1,请回答下列问题:
①写出NaHSO4在水溶液中的电离方程式_______________________________。
②NaHSO4属于________(填“酸”、“碱”或“盐”)。
③向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式:_______;在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式:_________。写出NaHSO4溶液与NaHCO3溶液混合的离子方程式_________。
(4)有以下物质:①石墨;②氯化氢气体;③酒精;④铝;⑤二氧化碳;⑥碳酸氢钠固体;⑦氢氧化钡溶液;⑧液态醋酸;⑨氯化银固体;⑩氨气。
①其中能导电的是:____________________________;
②属于非电解质的是:__________________________。
答案
(1)溶液中的离子浓度很小,几乎不导电
(2)②
(3)NaHSO4=Na++H++SO![]() 盐 2H++SO
盐 2H++SO![]() +Ba2++2OH−=BaSO4↓+2H2O Ba2++SO
+Ba2++2OH−=BaSO4↓+2H2O Ba2++SO![]() =BaSO4↓
=BaSO4↓
HCO![]() +H+=CO2↑+H2O
+H+=CO2↑+H2O
(4)①④⑦ ③⑤⑩

 H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L