在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
请回答下列问题:
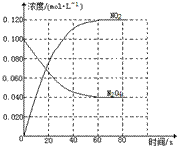
(1)该反应的△H_______0(填“<”或“>”);100℃时,体系中各物质浓度随时间变化如右图所示。在0~60s时段,反应速率v(N2O4)为_______mol·L-1·s-1 ,该反应的平衡常数K为__________。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10s又达到平衡。T_______100℃(填“<”或“>”),判断理由是_____________________________。
(3)恒温恒容条件下向上述平衡体系中通入氦气,平衡_____移动(填“向左”、“向右”或“不”);
答案
【答案】 (1).> (2).10-3 (3).0.36 (4).> (5).该反应的正反应为吸热过程 (6).不
【解析】
试题分析:(1)NO2是红棕色气体,N2O4是无色气体,升高温度,气体颜色加深,说明升高温度,平衡正向移动,根据平衡移动移动,升高温度,平衡向吸热反应方向移动,所以该反应的正反应是吸热反应;故△H>0;在100℃时,在0~60s时段,△c(N2O4)=0.060mol/L,所以反应速率v(N2O4)为=0.060mol/L÷60s=0.0010mol/(L·s);由于平衡时c(N2O4)=0.040mol/L,c(NO2)=0.120mol/L,所以反应的平衡常数K1为![]() 。(2) 100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10s又达到平衡。说明平衡正向移动,根据温度对化学平衡移动的影响:升高温度,平衡向吸热的正反应方向移动,所以T大于100℃;(3)温度T时反应达平衡后,将反应容器的容积减少一半,则体系的压强增大,根据平衡移动原理:增大压强,平衡向气体体积减小的方向移动,由于该反应的正反应是气体体积增大的反应,所以增大压强,平衡向逆反应方向移动。
。(2) 100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10s又达到平衡。说明平衡正向移动,根据温度对化学平衡移动的影响:升高温度,平衡向吸热的正反应方向移动,所以T大于100℃;(3)温度T时反应达平衡后,将反应容器的容积减少一半,则体系的压强增大,根据平衡移动原理:增大压强,平衡向气体体积减小的方向移动,由于该反应的正反应是气体体积增大的反应,所以增大压强,平衡向逆反应方向移动。
【考点定位】考查反应热的判断及温度、压强对化学平衡移动的影响的知识。
【名师点睛】化学反应的过程是原子重新组合的过程,在这个过程中要断裂反应物的化学键,需要吸收热量,形成生成物的化学键要释放热量,所以任何化学反应发生时都伴随着热量变化。根据平衡移动原理:升高温度,平衡向吸热反应方向移动,根据升高温度时气体颜色的变化确定平衡移动的方向,从而得到该反应的正反应是放热反应还是吸热反应。平衡移动原理的内容是:如果改变影响平衡的一个条件,平衡会向着能够减弱这种改变的方向移动。即升高温度温度,平衡向吸热反应方向移动;增大压强,平衡向气体体积减小的方向移动;增大反应物的浓度,平衡向正反应方向移动。但是平衡移动的趋势是微弱的,是不能改变这种变化趋势。
