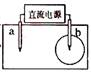
 取一张用饱和的NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈
取一张用饱和的NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈![]() 为白色,外圈呈浅红色。则下列说法错误的是( )
为白色,外圈呈浅红色。则下列说法错误的是( )
A.b电极是阴极 B.a电极与电源的正极相连
C.电解过程中水是氧化剂 D.b电极附近溶液的pH变小
 【错误分析】错选A或B,依据图示,b处出现圆圈,说明b极产生氯气,所以b为阳极与电源正极相连,a为阴极与电源负极相连。
【错误分析】错选A或B,依据图示,b处出现圆圈,说明b极产生氯气,所以b为阳极与电源正极相连,a为阴极与电源负极相连。
![]()
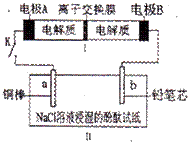 右图所示装置I是一种可充电电池,装置II为电解池。离子交换膜只允许Na
右图所示装置I是一种可充电电池,装置II为电解池。离子交换膜只允许Na![]() 通过,充 放电的化学方程式为2Na2S2+NaBr3 Na2S4+3NaBr。闭合开关K时,b极附近先变红色。下列说法正确的是
通过,充 放电的化学方程式为2Na2S2+NaBr3 Na2S4+3NaBr。闭合开关K时,b极附近先变红色。下列说法正确的是
A.负极反应为4Na![]() 4e
4e![]() =
=![]() 4Na
4Na![]()
B.当有0.01 mol Na![]() 通过离子交换膜时,b电极上析出标准状况下的气体
通过离子交换膜时,b电极上析出标准状况下的气体![]() 112 mL
112 mL
C.闭合K后,b电极附近的pH变小
D.闭合K后,a电极上有气体产生
【错误分析】错选C或D,错选C认为b极发生了
2Cl--2e- ===Cl2↑,Cl2+ H2O=HCl+HClO,错选D是认为a 极发生了2H2O-2e- ===H2↑+
2OH-。对于电解饱和食盐水原理不清析,阳极电极反应式为:2Cl--2e- ===Cl2↑,阴极电极反应式为:2H2O-4e- ===H2↑+2OH-,活波金属与电源正极相连首先失去电子。
【答案】B
【状元纠错】本题信息新颖,多数同学被所给的电池反应很不熟悉,习惯写出电极式的同学会因为写不出电极反应式而做不出来。电源的正极:Br3-+2 e-=3Br- 电源的负极2 S22--2 e-= S42-,内电路为Na+移动导电。由题意可知b极(阴极):2H2O-2e- ===H2↑+2OH-,a 极(阳极):Cu-2 e-= Cu2+,所以C,D均错误。对于B项当有0.01 mol Na![]() 通过离子交换膜时,说明有内电路通过了0.01 mol的电荷,外电路转移的电子也就为0.01 mol。结合b极反应,产生的气体就为0.005 mol,体积为112 mL。只有B正确。
通过离子交换膜时,说明有内电路通过了0.01 mol的电荷,外电路转移的电子也就为0.01 mol。结合b极反应,产生的气体就为0.005 mol,体积为112 mL。只有B正确。
燃料电池是燃料(如CO,H2,CH4等)跟氧气(或空气)起反应将化学能转变为电能的装置,电解质溶液是强碱溶液,下面关于甲烷燃料电池的说法正确的是
A.负极反应式:O2+2H2O+4e==4OH-
B.负极反应式:CH4+8OH--8e==CO2+6H2O
C.随着放电的进行,溶液的pH值不变
D.放电时溶液中的阴离子向负极移动
【答案】D
 负极反应的另一误区是,不考虑介质环境,反应产物与实际不符。如燃料氧化生成的二氧化碳不可能从强碱溶液中逸出,它将进一步反应转化成碳酸根。所以负极反应式为:
负极反应的另一误区是,不考虑介质环境,反应产物与实际不符。如燃料氧化生成的二氧化碳不可能从强碱溶液中逸出,它将进一步反应转化成碳酸根。所以负极反应式为:
![]()
由于部分碱液和二氧化碳反应,所以溶液的pH值将减小。选项C为错误结论。类似铅蓄电池在放电时,介质为硫酸溶液,所以负极反应式为:
![]()
以上还应归纳的:①在碱性溶液中:缺氧,应由氢氧根离子提供,剩下转化为水;氧多,应和水结合生成氢氧根离子。②在中性溶液中:缺氧,应由水提供,剩下转化为氢离子;氧多,应和水结合生成氢氧根离子。③在酸性溶液中:缺氧,应由水提供,剩下转化为氢离子;氧多,应和氢离子结合生成水。总之,溶液的酸碱性变化应是由酸性→中性→碱性或碱性→中性→酸性。
【状元纠错】 不考虑介质环境、离子方程式书写错误
在盛有稀H2SO4的烧杯中放入导线连接的锌片和铜片,下列叙述正确的是( )
A.正极附近的SO42-离子浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.正极有O2逸出
D.铜片上有H2逸出
【答案】D
【解析】本题符合铜锌原电池的形成条件,原电池工作时,电子由负极(锌)经外电路(导线)流向正极(铜)。负极锌片:Zn-2e-![]() Zn2+;正极铜片:2H++2e-
Zn2+;正极铜片:2H++2e-![]() H2↑,总反应为:Zn+2H+
H2↑,总反应为:Zn+2H+![]() Zn2++ H2↑,原电池中没有产生O2。没有参与反应的SO42-离子浓度不会逐渐增大。
Zn2++ H2↑,原电池中没有产生O2。没有参与反应的SO42-离子浓度不会逐渐增大。
【状元纠错】原电池工作时,电子由负极流向正极(电流由正极流向负极)。不参与电极反应的离子不能定向移动,这种离子在溶液的各个区域浓度基本不变。
如图所示各容器中盛有海水,铁在其中被腐蚀由快到慢的顺序是( )
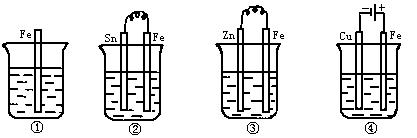
A. ④>②>①>③ B. ②>①>③>④
C. ④>②>③>① D. ③>②>④>①
【答案】 A
【解析】金属腐蚀在此条件下主要是电化学腐蚀,通常从原电池原理以及电解的原理进行分析。当铁与比它不活泼的金属连在一起构成原电池时,铁为负极,被腐蚀的速度增大,②>①;当铁与比它活泼的金属连接,构成原电池时,铁是正极,铁被保护,被腐蚀的速度减小,③<①;在电解装置中,铁接电源的正极,铁被腐蚀的速度加快,因此,腐蚀速度 ④>②>①>③ 。
【状元纠错】金属腐蚀快慢的判断:
电解原理引起的腐蚀>原电池原理引起的腐蚀>![]() 化学腐蚀>有防腐蚀措施的腐蚀;
化学腐蚀>有防腐蚀措施的腐蚀;
本卷还有12题,登录并加入会员即可免费使用哦~

该作品由: 用户李昆分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。