采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。回答下列问题
(1)1840年 Devil用干燥的氯气通过干燥的硝酸银,得到N2O5。该反应的氧化产物是一种气体,其分子式为___________。
(2)F. Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:

其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示(t=∞时,N2O4(g)完全分解):
| t/min | 0 | 40 | 80 | 160 | 260 | 1300 | 1700 | ∞ |
| p/kPa | 35.8 | 40.3 | 42.5. | 45.9 | 49.2 | 61.2 | 62.3 | 63.1 |
①已知:2N2O5(g)=2N2O5(g)+O2(g) ΔH1=−4.4 kJ·mol−1
2NO2(g)=N2O4(g) ΔH 2=−55.3 kJ·mol−1
则反应N2O5(g)=2NO2(g)+![]() O2(g)的ΔH =_______ kJ·mol−1。
O2(g)的ΔH =_______ kJ·mol−1。
②研究表明,N2O5(g)分解的反应速率![]() 。t=62 min时,测得体系中
。t=62 min时,测得体系中![]() pO2=2.9 kPa,则此时的
pO2=2.9 kPa,则此时的![]() =________ kPa,v=_______kPa·min−1。
=________ kPa,v=_______kPa·min−1。
③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)____63.1 kPa(填“大于”“等于”或“小于”),原因是________。
④25℃时N2O4(g)![]() 2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
2NO2(g)反应的平衡常数Kp=_______kPa(Kp为以分压表示的平衡常数,计算结果保留1位小数)。
(3)对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:
第一步 N2O5![]() NO2+NO3 快速平衡
NO2+NO3 快速平衡
第二步 NO2+NO3→NO+NO2+O2 慢反应
第三步 NO+NO3→2NO2 快反应
其中可近似认为第二步反应不影响第一步的平衡。下列表述正确的是_______(填标号)。
A.v(第一步的逆反应)>v(第二步反应)
B.反应的中间产物只有NO3
C.第二步中NO2与NO3的碰撞仅部分有效
D.第三步反应活化能较高
【答案】O2 53.1 30.0 6.0×10-2 大于 温度提高,体积不变,总压强提高;NO2二聚为放热反应,温度提高,平衡左移,体系物质的量增加,总压强提高 13.4 AC

CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol−1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol−1
C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol−1
该催化重整反应的ΔH==______ kJ·mol−1。有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______mol2·L−2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
相关数据如下表:
| 积碳反应 CH4(g)=C(s)+2H2(g) | 消碳反应 CO2(g)+C(s)=2CO(g) | ||
| ΔH/(kJ·mol−1) | 75 | 172 | |
| 活化能/ (kJ·mol−1) | 催化剂X | 33 | 91 |
| 催化剂Y | 43 | 72 | |
①由上表判断,催化剂X____Y(填“优于”或“劣于”),理由是_________________。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________填标号)。
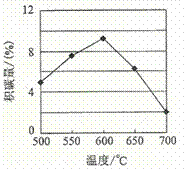
A.K积、K消均增加 B.v积减小,v消增加
C.K积减小,K消增加 D.v消增加的倍数比v积增加的倍数大
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________。
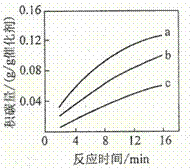
【答案】247 A ![]() 劣于 相对于催化剂X,催化剂Y积碳反应的活化能大,积碳反应的速率小;而消碳反应活化能相对小,消碳反应速率大 AD pc(CO2)、pb(CO2)、pa(CO2)
劣于 相对于催化剂X,催化剂Y积碳反应的活化能大,积碳反应的速率小;而消碳反应活化能相对小,消碳反应速率大 AD pc(CO2)、pb(CO2)、pa(CO2)


三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:
(1)SiHCl3在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成(HSiO)2O等,写出该反应的化学方程式__________。
(2)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g)![]() SiH2Cl2(g)+ SiCl4(g) ΔH1=48 kJ·mol−1
SiH2Cl2(g)+ SiCl4(g) ΔH1=48 kJ·mol−1
3SiH2Cl2(g)![]() SiH4(g)+2SiHCl3 (g) ΔH2=−30 kJ·mol−1
SiH4(g)+2SiHCl3 (g) ΔH2=−30 kJ·mol−1
则反应4SiHCl3(g)![]() SiH4(g)+ 3SiCl4(g)的ΔH=__________ kJ·mol−1。
SiH4(g)+ 3SiCl4(g)的ΔH=__________ kJ·mol−1。
(3)对于反应2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。

①343 K时反应的平衡转化率α=_________%。平衡常数K343 K=__________(保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是___________;要缩短反应达到平衡的时间,可采取的措施有____________、___________。
③比较a、b处反应速率大小:υa________υb(填“大于”“小于”或“等于”)。反应速率υ=υ正−υ逆=![]() −
−![]() ,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处
,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处![]() =__________(保留1位小数)。
=__________(保留1位小数)。
【答案】 2SiHCl3+3H2O![]() (HSiO)2O+6HCl 114 ①22 0.02 ②及时移去产物 改进催化剂 提高反应物压强(浓度) ③大于 1.3
(HSiO)2O+6HCl 114 ①22 0.02 ②及时移去产物 改进催化剂 提高反应物压强(浓度) ③大于 1.3
【解析】(1)根据题目表述,三氯氢硅和水蒸气反应得到(HSiO)2O,方程式为:2SiHCl3+3H2O=(HSiO)2O+6HCl。

氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:
已知:2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol
C(s)+O2(g)=CO2(g) △H=- 393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
(1)若某反应的平衡常数表达式为K=![]() ,请写出此反应的热化学方程式:___________________________;下列措施能够增大此反应中NO的转化率的是(填字母代号)_________。
,请写出此反应的热化学方程式:___________________________;下列措施能够增大此反应中NO的转化率的是(填字母代号)_________。
a.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(S)+2NO(g)![]() N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
| 物质的量/mol | T1/℃ | T2/℃ | |||||
| 0 | 5 min | 10 min | 15 min | 20 min | 15 min | 30 min | |
| NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
| N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
①0~5min内,以CO2表示的该反应速率v(CO2)=______,该条件下的平衡常数K=_______________。
②第15 min后,温度调整到T2,数据变化如上表所示,则T1_______ T2(填“>”、“<”或“=”)。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则此时反应_______移动(填“正向”、“逆向”或“不”);最终达平衡时NO的转化率a=______________。
(3)工业上可以用氨水除去反应C(s)+2NO(g)![]() N2(g)+CO2(g)中产生的CO2,得到NH4HCO3溶液,反应NH4++HCO3-+H2O
N2(g)+CO2(g)中产生的CO2,得到NH4HCO3溶液,反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=________________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5, H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
NH3·H2O+H2CO3的平衡常数K=________________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5, H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
【答案】 2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-747 kJ/mol ad 0.042mol·L-1·min-1
N2(g)+2CO2(g) △H=-747 kJ/mol ad 0.042mol·L-1·min-1 ![]() > 正向 60% 1.25×10-3
> 正向 60% 1.25×10-3
【解析】(1)根据平衡常数的定义,若平衡常数表达式为K=![]() ,则化学方程式为:2CO(g)+2NO(g)
,则化学方程式为:2CO(g)+2NO(g)![]() N2(g)+2CO2(g),已知①2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol,
N2(g)+2CO2(g),已知①2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol,
②C(s)+O2(g)=CO2(g) △H=- 393.5 kJ/mol,③N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
根据盖斯定律:②×2-①-③得:2CO(g)+2NO(g)![]() N2(g)+2CO2(g) △H=-747 kJ/mol; 由于该反应是气体体积减小的放热反应a.增大容器压强平衡正向移动NO转化率增大,a正确;b.升高温度平衡逆向移动,NO
N2(g)+2CO2(g) △H=-747 kJ/mol; 由于该反应是气体体积减小的放热反应a.增大容器压强平衡正向移动NO转化率增大,a正确;b.升高温度平衡逆向移动,NO  数为定值,新平衡时有:
数为定值,新平衡时有:![]() =4,解得x=0.2;经计算NO起始总量为2mol+2mol=4mol,达到新平衡时NO的物质的量为(1.2-2×0.2)mol/L×2L=1.6mol,转化的NO共4mol-1.6mol=2.4mol,所以最终达平衡时NO的转化率a=
=4,解得x=0.2;经计算NO起始总量为2mol+2mol=4mol,达到新平衡时NO的物质的量为(1.2-2×0.2)mol/L×2L=1.6mol,转化的NO共4mol-1.6mol=2.4mol,所以最终达平衡时NO的转化率a=![]() 。
。
(3)NH4++HCO3-+H2O![]() NH3·H2O+H2CO3,平衡常数K=
NH3·H2O+H2CO3,平衡常数K=![]() =
=![]() =
=![]() =1.25×10-3。
=1.25×10-3。
I.(1)利用水蒸气或二氧化碳对甲烷进行重整是提高甲烷利用率的重要方式水蒸气重整:
CH4(g)+H2O(g) ![]() CO(g)+3H2(g) △H1=+205.9 KJ·mol-1 ①
CO(g)+3H2(g) △H1=+205.9 KJ·mol-1 ①
CO(g)+H2O(g) ![]() CO2(g)+H2(g) △H 2 =-41.2 KJ·mol-1 ②
CO2(g)+H2(g) △H 2 =-41.2 KJ·mol-1 ②
二氧化碳重整:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) △H 3 ③
2CO(g)+2H2(g) △H 3 ③
则反应①自发进行的条件是____________,△H3 =___________KJ·mol-1![]()
Ⅱ.2017年7月10日我国甲烷、二氧化碳重整制合成气装置在山西实现全系统运行,减少了温室气体的排放。
(2)某2L恒容密闭容器中,投入2 mol CH4和2 mol CO2,不同温度下平衡体系中CH4和CO的物质的量分数![]() /(y)%随温度变化如右图所示:
/(y)%随温度变化如右图所示:![]()

①T1温度下该反应的平衡常数是_________
②2c点CH4的物质的量分数为_________
③v逆:a_________b点(填“>”、“<”、“=”、“无法确定”),理由是________![]() 。
。
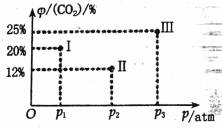
(3)现有温度相同的I、II、III三个恒压密闭容器,均已充入1 mol CH4(g)和1 mol CO2(g),三个容器的反应压强分别为p1atm、p2atm、p3atm,在其他条件相同的的情况下,反应进行到tmin时,CO2的体积分数如下图,此时I、II、III三个容器中可能处于化学平衡状态的是_________![]() 。
。
III.(4)以多孔石墨为阳极,以NaCl和NaOH的混合溶液作电解液,用电解法由甲烷制取甲醇。写出阳极的电极反应式:________________。
【答案】 高![]() 温 +247.1
温 +247.1 ![]() mol2/L2 10% < 与a点相比,b点温度更高且CO、H2浓度更大 III CH4+2OH--2e-=CH3OH+H2 O
mol2/L2 10% < 与a点相比,b点温度更高且CO、H2浓度更大 III CH4+2OH--2e-=CH3OH+H2 O
【解析】I.(1) 反应①CH4(g)+H2O(g) ![]() CO(g)+3H2(g) △H1=+205.9 KJ·mol-1自发进行,则△G=△H-T△S <0,反应为熵增焓增的反应,则高温条件有利于自发进行;已知①CH4 (g)+H2O(g)
CO(g)+3H2(g) △H1=+205.9 KJ·mol-1自发进行,则△G=△H-T△S <0,反应为熵增焓增的反应,则高温条件有利于自发进行;已知①CH4 (g)+H2O(g) ![]() CO(g)+3H2(g)
CO(g)+3H2(g) 
本卷还有6题,登录并加入会员即可免费使用哦~

该作品由: 用户阿基米德分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。