25 ℃时,下列溶液中粒子的物质的量浓度关系正确的是( )
A.向浓度为0.1 mol·L-1的NaHCO3溶液中滴加少量盐酸后所得溶液中:
c(Na+)=c(CO![]() )+c(HCO
)+c(HCO![]() )+c(H2CO3)
)+c(H2CO3)
B.pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合所得溶液中:
c(CH3COO-)+c(H+)<c(Na+) +c(OH-)
C. 0.1 mol·L-1CH3COOH溶液和0.1 mol·L-1CH3COONa溶液等体积混合:
c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
D.0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液至中性:
c(Na+)>c(SO![]() )>c(NH
)>c(NH![]() )>c(OH-)=c(H+)
)>c(OH-)=c(H+)
答案 D
解析 A项,由于滴加少量盐酸后,有少量CO2逸出,所以c(Na+)>c(CO![]() )+c(HCO
)+c(HCO![]() )+c(H2CO3);B项,由于c(CH3COO-)+c(OH-)=c(Na+)+c(H+),溶液混合后呈酸性,c(H+)>
)+c(H2CO3);B项,由于c(CH3COO-)+c(OH-)=c(Na+)+c(H+),溶液混合后呈酸性,c(H+)>
c(OH-),所以c(CH3COO-)+c(H+)>c(Na+)+c(OH-);C项,由于CH3COOH的电离大于CH3COO-的水解,所以c(CH3COO-)应大于c(CH3COOH)。
室温下向10 mL 0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA溶液pH的变化曲线如图所示。下列说法正确的是( )

A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.pH=7时,c(Na+)=c(A-)+c(HA)
D.b点所示溶液中c(A-)>c(HA)
答案 D
解析 a点时酸碱恰好中和,溶液pH=8.7,说明HA为弱酸,NaA溶液水解呈碱性,应为c(HA)>c(H+),故A错误;a点时A-水解,促进水的电离,b点时HA过量,溶液呈酸性,HA电离出H+,抑制水的电离,故B错误;pH=7时,c(H+)=c(OH-),由电荷守恒可知
c(Na+)+c(H+)=c(A-)+c(OH-),则c(Na+)=c(A-),故C错误;b点HA过量一倍,溶液中存在NaA和HA,溶液呈酸性,说明HA电离程度大于A-水解程度,则存在c(A-)>c(HA),故D正确。
25 ℃时,取浓度为0.100 0 mol·L-1的氨水20.00 mL,用0.100 0 mol·L-1盐酸滴定,过程中pH随滴加溶液的体积变化关系如图所示:
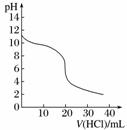
下列说法正确的是( )
A.25 ℃时Kb (NH3·H2O) ≈10-5
B.滴定过程中水的电离程度一直保持增大趋势
C.为使终点现象更加明显可多加上几滴甲基橙
D.滴定终点时c(NH![]() )=c(Cl-)>c(H+)=c(OH-)
)=c(Cl-)>c(H+)=c(OH-)
答案 A
解析 根据图知,未加盐酸时氨水pH=11,则氨水中c(OH-)=![]() mol·L-1=0.001
mol·L-1=0.001
mol·L-1,氨水溶液中c(NH![]() )≈c(OH-)=0.001 mol·L-1,Kb(NH3·H2O)=
)≈c(OH-)=0.001 mol·L-1,Kb(NH3·H2O)=![]() =
=![]() =10-5,故A正确;酸或碱抑制水电离,含有弱离子的盐促进水电离,所以开始时氨水抑制水电离,随着盐酸的滴加,溶液中铵根离子浓度增大,碱性减弱,水的电离程度增大,当二者恰好完全反应时水的电离程度最大,继续滴加盐酸,溶液呈酸性,抑制水电离,故B错误;由于指示剂能够与酸或者碱溶液反应,在中和滴定时不能滴加过多的指示剂,否则会影响测定结果,故C错误;滴定终点时,溶液由黄色变为红色,溶液呈酸性,再结合电荷守恒得c(NH
=10-5,故A正确;酸或碱抑制水电离,含有弱离子的盐促进水电离,所以开始时氨水抑制水电离,随着盐酸的滴加,溶液中铵根离子浓度增大,碱性减弱,水的电离程度增大,当二者恰好完全反应时水的电离程度最大,继续滴加盐酸,溶液呈酸性,抑制水电离,故B错误;由于指示剂能够与酸或者碱溶液反应,在中和滴定时不能滴加过多的指示剂,否则会影响测定结果,故C错误;滴定终点时,溶液由黄色变为红色,溶液呈酸性,再结合电荷守恒得c(NH![]() )<c(Cl-),溶液中氢离子浓度较小,所以离子浓度大小顺序是c(Cl-)>c(NH
)<c(Cl-),溶液中氢离子浓度较小,所以离子浓度大小顺序是c(Cl-)>c(NH![]() )>c(H+)>c(OH-),故D错误;故选A。
)>c(H+)>c(OH-),故D错误;故选A。
溶液的酸碱性可用酸度(AG)表示,AG=lg![]() 。室温下,将0.01 mol·L-l盐酸逐滴滴入20.00 mL 0.01 mol·L-1氨水中,溶液的AG变化如图所示。下列说法正确的是( )
。室温下,将0.01 mol·L-l盐酸逐滴滴入20.00 mL 0.01 mol·L-1氨水中,溶液的AG变化如图所示。下列说法正确的是( )

A.室温下,0.01 mol·L-1盐酸的AG =12
B.M点时溶液中:c(NH![]() ) =c(Cl-)
) =c(Cl-)
C.M点加入盐酸的体积大于20.00 mL
D.M点以后NH![]() 的水解程度逐渐增大
的水解程度逐渐增大
答案 B
解析 A项,室温下,0.01 mol·L-1盐酸的c(H+)=10-2mol·L-1,c(OH-)=10-12mol·L-1,
c(H+)/c(OH-)=1010,AG=10,错误;B项,根据图像知M点时溶液中AG=0,c(H+)=
c(OH-),混合液中的电荷守恒式:c(H+)+c(NH![]() )=c(Cl-)+c(OH-),则c(NH
)=c(Cl-)+c(OH-),则c(NH![]() )=c(Cl-),正确;C项,M点溶液呈中性,加入盐酸的体积小于20.00 mL,错误;D项,M点以后随着盐酸的加入,溶液中氢离子浓度增大,抑制NH
)=c(Cl-),正确;C项,M点溶液呈中性,加入盐酸的体积小于20.00 mL,错误;D项,M点以后随着盐酸的加入,溶液中氢离子浓度增大,抑制NH![]() 的水解,错误。
的水解,错误。
室温下,将0.10 mol·L-1盐酸滴入20.00 mL 0.10 mol·L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示。已知:pOH=-lg c(OH-),下列说法正确的是( )
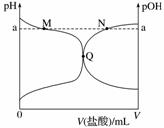
A.M点所示溶液中c(NH![]() )+c(NH3·H2O)=c(Cl-)
)+c(NH3·H2O)=c(Cl-)
B.N点所示溶液中c(NH![]() )>c(Cl-)
)>c(Cl-)
C.Q点消耗盐酸的体积等于氨水的体积
D.M点和N点所示溶液中水的电离程度相同
答案 D
解析 A中所示的式子必须在加入的盐酸的物质的量与氨水的物质的量相等时才满足,M点显然不成立;B中,N点,盐酸已经明显过量了,c(Cl-)>c(NH![]() );C中,Q点处溶液为中性,但是此时消耗盐酸的体积比氨水的体积小;D中,M点与N点对应的pH与pOH相同,所以对水的电离程度抑制作用相同,所以水的电离程度相同。
);C中,Q点处溶液为中性,但是此时消耗盐酸的体积比氨水的体积小;D中,M点与N点对应的pH与pOH相同,所以对水的电离程度抑制作用相同,所以水的电离程度相同。
本卷还有6题,登录并加入会员即可免费使用哦~

该作品由: 用户李晖分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。