资源的高效利用对保护环境、促进经济持续健康发展具有重要作用。磷尾矿主要含Ca5(PO4)3F和CaCO3·MgCO3 。某研究小组提出了磷尾矿综合利用的研究方案,制备具有重要工业用途的CaCO3、Mg(OH)2、P4和H2,其简化流程如下:
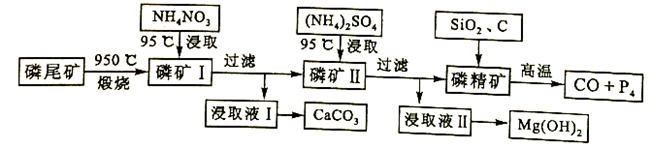
已知:①Ca5(PO4)3F在950℃不分解;
②4Ca5(PO4)3F+18SiO2+30C![]() 2CaF2+30CO+18CaSiO3+3P4
2CaF2+30CO+18CaSiO3+3P4
请回答下列问题:
(1)950℃煅烧磷尾矿生成气体的主要成分是___________。
(2)实验室过滤所需的玻璃仪器是_____________。
(3)NH4NO3溶液能从磷矿I中浸取出Ca2+的原因是__________。
(4)在浸取液II中通入NH3,发生反应的化学方程式是____________。
(5)工业上常用磷精矿Ca5(PO4)3F]和硫酸反应制备磷酸。已知25℃,101kPa时:
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) △H=-271kJ/mol
5 CaO(s)+H3PO4(l)+HF(g)= Ca5(PO4)3F (s)+5H2O(l) △H=-937kJ/mol
则Ca5(PO4)3F和硫酸反应生成磷酸的热化学方程式是_________________。
(6)在一定条件下CO(g)+H2O(g) ![]() CO2(g)+H2(g),当CO与H2O(g)的起始物质的量之比为1:5,达平衡时,CO转化了5/6.若akg含Ca5(PO4)3F(相对分子质量为504)的质量分数为10%的磷尾矿,在上述过程中有b%的Ca5(PO4)3F转化为P4,将产生的CO与H2O(g)按起始物质的量之比1:3混合,则相同条件下达平衡时能产生H2________kg。
CO2(g)+H2(g),当CO与H2O(g)的起始物质的量之比为1:5,达平衡时,CO转化了5/6.若akg含Ca5(PO4)3F(相对分子质量为504)的质量分数为10%的磷尾矿,在上述过程中有b%的Ca5(PO4)3F转化为P4,将产生的CO与H2O(g)按起始物质的量之比1:3混合,则相同条件下达平衡时能产生H2________kg。
【答案】(1)CO2 (2)漏斗、烧杯、玻璃棒。
(3)NH4+ 水解使溶液呈酸性,与CaO、Ca(OH)2反应生成Ca2+
(4)MgSO4+2NH3+2H2O===Mg(OH)2↓+(NH4)2SO4 。
(5)Ca5(PO4)3F (s)+ 5H2SO4(l)=5CaSO4(s) +H3PO4(l)+HF(g) △H=-418kJ/mol (6)![]()


以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
| 物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
| 质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
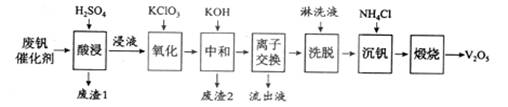
回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为___________,同时V2O4转成VO2+。“废渣1”的主要成分是__________________。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为______mol。
(3)“中和”作用之一是使钒以V4O124−形式存在于溶液中。“废渣2”中含有_______。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124−![]() R4V4O12+4OH−(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”“碱”“中”)。
R4V4O12+4OH−(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”“碱”“中”)。
(5)“流出液”中阳离子最多的是________。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
【答案】(1)V2O5+2H+=2VO2++H2O;SiO2;(2)0.5;(3)Fe(OH)3、Al(OH)3;(4)碱;(5)K+ ;
(6)2NH4VO3![]() V2O5+H2O+2NH3↑。
V2O5+H2O+2NH3↑。
 【考点定位】考查物质制备工艺流程图分析
【考点定位】考查物质制备工艺流程图分析
【名师点睛】本题是工艺流程问题,涉及氧化还原反应方程式的书写、步骤的分析、氧化还原反应的计算、元素及其化合物的性质等知识,发挥理论对实践的指导作用,将其应用于实践来解决实际问题,达到学以致用的目的。充分体现了“源于教材又不拘泥于教材”的指导思想,在一定程度上考查了学生的知识的灵活运用能力和分析问题解决问题的能力。书写离子反应方程式,首先找出反应物和生成物,然后判断此反应是否属于氧化还原反应,最后根据原子守恒、反应前后电荷守恒配平其他;工艺流程中充分把握题目所给数据,如本题中SiO2的质量分数在60%~65%,因此滤渣1的主要成分是SiO2,因为SiO2属于酸性氧化物,不与硫酸反应;氧化还原反应实质是电子的得失或偏移,即得失电子数目守恒,氧化还原反应的计算常常采用得失电子数目守恒进行计算,即氧化剂的物质的量×变价原子个数×化合价的变化值=还原剂的物质的量×变价原子个数×化合价的变化值,本题是3×1×1=n(KClO3)×1×6,解得x=0.5mol;化学平衡原理适用于任何化学平衡,如果改变影响平衡的一个条件,化学平衡会向能够减弱这种改变的方向移动。本题难度适中。
锶(Sr)为第五周期IIA族元素,其化合物六水氯化锶(SrCl2·6H2O)是实验室重要的分析试剂,工业上常以天青石(主要成分为SrSO4)为原料制备,生产流程如下:
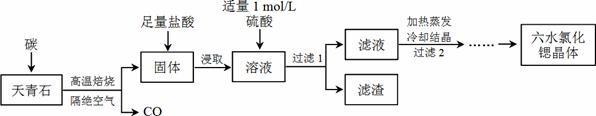
(1)工业上天青石焙烧前先研磨粉碎,其目的是_________________________________________。
(2)工业上天青石隔绝空气高温焙烧,若0.5 mol SrSO4中只有S被还原,转移了4 mol电子。写出该反应的化学方程式:_____________________________________________。
(3)加入硫酸的目的是______________________。为了提高原料的利用率,滤液中Sr2+的浓度应不高于_________ mol/L(注:此时滤液中Ba2+浓度为1×10-5mol/L)。
(4)产品纯度检测:称取1.000 g产品溶解于适量水中,向其中加入含AgNO31.100×10-2mol的AgNO3溶液(溶液中除Cl-外,不含其它与Ag+反应的离子),待Cl-完全沉淀后,用含Fe3+的溶液作指示剂,用0.2000 mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出。
①滴定反应达到终点的现象是_________________________________________。
②若滴定过程用去上述浓度的NH4SCN溶液20.00 mL,则产品中SrCl2·6H2O的质量百分含量为______________(保留4位有效数字)。
(5)工业上常用电解熔融SrCl2制锶单质。由SrCl2·6H2O制取无水氯化锶的方法是____________。
【答案】增加反应物的接触面积,提高化学反应速率SrSO4+4C![]() SrS+4CO↑除去溶液中Ba2+杂质0.03加1滴NH4SCN溶液溶液由无色变为红色,且30 s内不褪色93.45%加热SrCl2·6H2O失去结晶水至恒重(或灼烧等)
SrS+4CO↑除去溶液中Ba2+杂质0.03加1滴NH4SCN溶液溶液由无色变为红色,且30 s内不褪色93.45%加热SrCl2·6H2O失去结晶水至恒重(或灼烧等)

 点睛:本题考查制备实验方案的设计,把握制备流程中发生的化学反应及物质分离方法为解答的关键。以天青石(主要成分为SrSO4)为原料制备六水氯化锶(SrCl2•6H2O),由流程可知,天青石和碳隔绝空气高温焙烧生成CO、SrS,SrS加盐酸后溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质,然后加硫酸生成硫酸钡沉淀,所以过滤后滤渣为硫酸钡,滤液中含SrSO4、SrCl2,最后蒸发、冷却结晶得到SrCl2•6H2O。
点睛:本题考查制备实验方案的设计,把握制备流程中发生的化学反应及物质分离方法为解答的关键。以天青石(主要成分为SrSO4)为原料制备六水氯化锶(SrCl2•6H2O),由流程可知,天青石和碳隔绝空气高温焙烧生成CO、SrS,SrS加盐酸后溶液中除含有Sr2+和Cl-外,还含有少量Ba2+杂质,然后加硫酸生成硫酸钡沉淀,所以过滤后滤渣为硫酸钡,滤液中含SrSO4、SrCl2,最后蒸发、冷却结晶得到SrCl2•6H2O。
以炼锌厂的烟道灰(主要成分为ZnO,另含少量Fe2O3、CuO、SiO2、MnO等)为原料可生产草酸锌晶体(ZnC2O4·2H2O)。
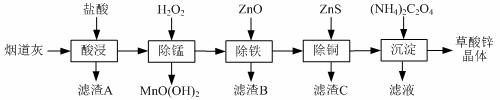
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 3.3 | 9.7 | 6.7 | 8.2 |
请问答下列问题:
(1)滤渣A的主要成分为________,滤渣B的主要成分为________。
(2)除锰过程中产生MnO(OH)2沉淀的离子方程式为____________________。
(3)①除铁(部分Cu2+可能被除去)时加入ZnO控制反应液pH的范围为________。
②上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是__________。
(4)沉淀后要获得干燥纯净草酸锌晶体,需进行的操作是_____________。
(5)将草酸锌晶体加热分解可得到一种纳米材料。加热过程中固体残留率随温度的变化如下图所示,300 ℃~460 ℃范围内,发生反应的化学方程式为_______。
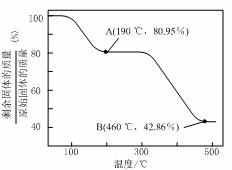
【答案】SiO2Fe(OH)3Mn2++H2O2+H2O= MnO(OH)2↓+2H+3.3~5.4先加入MnS会将Fe3+还原为Fe2+,使铁元素难以除去过滤 洗涤 干燥(或烘干)ZnC2O4![]() ZnO+CO↑+CO2↑
ZnO+CO↑+CO2↑
 方程式为:ZnC2O4
方程式为:ZnC2O4 ![]() ZnO+CO↑+CO2↑,故答案为:ZnC2O4
ZnO+CO↑+CO2↑,故答案为:ZnC2O4 ![]() ZnO+CO↑+CO2↑。
ZnO+CO↑+CO2↑。
工业上“中温焙烧——钠化氧化法”回收电镀污泥中的铬已获技术上的突破。其工艺流程如下:

【查阅资料】
①电镀污泥中含有Cr(OH)3、Al203、ZnO、CuO、NiO等物质;水浸后溶液中含有Na2CrO4、NaAlO2、Na2ZnO2等物质;
②Na2CrO4转化成Na2Cr2O7离子反应方程式为:2 CrO42-+2H+=Cr2O72-+H2O;③Na2SO4、Na2Cr2O7、Na2CrO4在不同温度下的溶解度如下表:

请回答:
(1)操作①的名称是_____, “水浸”后的溶液呈_______性;
(2)“焙烧氧化”过程中Cr(OH)3转化成Na2CrO4的化学方程式为___________;
(3)滤渣II的主要成分有Zn(OH)2和X,生成X的离子反应方程式__________;
(4)“酸化浓缩”时,需继续加入H2SO4,然后_____、结晶、过滤。继续加入H2SO4目的是__________;
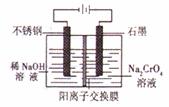
(5)以铬酸钠为原料,电化学法制备重铬酸钠的实验装置如右图所示
 。
。
①阴极发生的电极反应式为:_____________;
②若测定阳极液中Na与Cr的物质的量之比值为d,则此时铬酸钠的转化率为___________。
【答案】过滤碱4Cr(OH)3+ 4 Na2CO3+ 3O2![]() 4Na2CrO4+4CO2+6H2OAlO2–+H++ H2O
4Na2CrO4+4CO2+6H2OAlO2–+H++ H2O![]() Al(OH)3↓蒸发浓缩促使反应2CrO42-+2H+
Al(OH)3↓蒸发浓缩促使反应2CrO42-+2H+![]() Cr2O72-+H2O平衡向正方向移动2H2O+2e-=2OH-+H2↑(或2H++2e-=H2↑)2-d
Cr2O72-+H2O平衡向正方向移动2H2O+2e-=2OH-+H2↑(或2H++2e-=H2↑)2-d

 点睛:电解过程中钠离子通过阳离子交换膜进入阴极室,所以右侧阳极室中钠离子减少。
点睛:电解过程中钠离子通过阳离子交换膜进入阴极室,所以右侧阳极室中钠离子减少。
本卷还有3题,登录并加入会员即可免费使用哦~

该作品由: 用户yangzhiqi分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。