焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中、受热时均易分解。实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2,实验装置如下图所示。
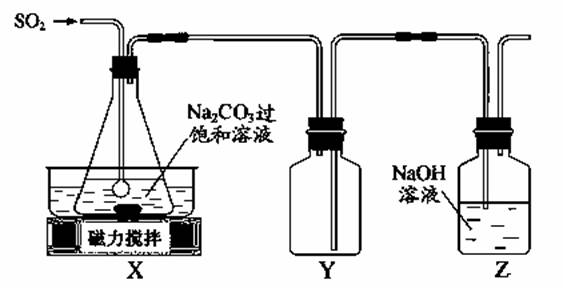
当溶液pH约为4时,停止反应,在20℃左右静置结晶。生成Na2S2O5的化学方程式为
2NaHSO3=Na2S2O5+H2O
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其离子方程式为____________________。
(2)装置Y的作用是______________________________。
(3)析出固体的反应液经减压抽滤、洗涤、25℃~30℃干燥,可获得Na2S2O5固体。
①组成减压抽滤装置的主要仪器是布氏漏斗、________________和抽气泵。
②依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体。用饱和SO2水溶液洗涤的目的是______。
(4)实验制得的Na2S2O5固体中含有一定量的Na2SO3和Na2SO4,其可能的原因是______。
【答案】(1)2SO2+CO32-+H2O=2HSO3-+CO2 (2)防止倒吸 (3)①抽滤瓶;
②减少Na2S2O5的在水中的溶解;
(4)在制备过程中Na2S2O5分解生成生Na2SO3,Na2SO3被氧化生成Na2SO4。

无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1,主要步骤如下:
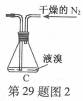
步骤1 三颈瓶中装入10 g镁屑和150 mL无水乙醚;装置B中加入15 mL液溴。
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3 反应完毕后恢复至室温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4 常温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160 ℃分解得无水MgBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性。
②MgBr2+3C2H5OC2H5![]() MgBr2·3C2H5OC2H5
MgBr2·3C2H5OC2H5
请回答:
(1)仪器A的名称是____________。实验中不能用干燥空气代替干燥N2,原因是___________。
(2)如将装置B改为装置C(图2),可能会导致的后果是___________。
(3)步骤3中,第一次过滤除去的物质是___________。
(4)有关步骤4的说法,正确的是___________。
A.可用95%的乙醇代替苯溶解粗品 B.洗涤晶体可选用0℃的苯
C.加热至160℃的主要目的是除去苯 D.该步骤的目的是除去乙醚和可能残留的溴
(5)为测定产品的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:
Mg2++ Y4-====Mg Y2-
①滴定前润洗滴定管的操作方法是__________。
②测定前,先称取0.2500g无水MgBr2产品,溶解后,用0.0500 mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50 mL,则测得无水MgBr2产品的纯度是________________________(以质量分数表示)。
【答案】(1)干燥管 防止镁屑与氧气反应,生成的MgO阻碍Mg和Br2的反应
(2)会将液溴快速压入三颈瓶,反应过快大量放热而存在安全隐患(3)镁屑(4)BD
(5)①从滴定管上口加入少量待测液,倾斜着转动滴定管,使液体润湿内壁,然后从下部放出,重复2-3次 ②97.5%

亚硝酸钠是重要的防腐剂。某化学兴趣小组以碳和浓硝酸为起始原料,设计如下装置利用一氧化氮与过氧化钠反应制备亚硝酸钠。(夹持装置和A中加热装置已略,气密性已检验)
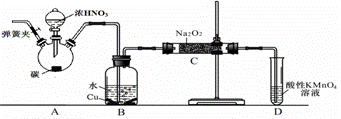
查阅资料:①HNO2为弱酸,室温下存在反应3HNO2=HNO3+2NO↑+H2O;
②在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成。
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸
实验操作:①关闭弹簧夹,打开A中分液漏斗活塞,滴加一定量浓硝酸,加热;
②一段时间后停止加热;
③从C中取少量固体,检验是否是亚硝酸钠。
(1)A中反应的化学方程式是 。
(2)B中观察的主要现象是 ,D装置的作用是 。
(3)检验C中产物有亚硝酸钠的操作是 。
(4)经检验C产物中亚硝酸钠含量较少。
a.甲同学认为C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠。
生成碳酸钠的化学方程式是 。为排除干扰甲在B、C装置间增加装置E,E中盛放的试剂应是 (写名称)。
b.乙同学认为除上述干扰因素外,还会有空气参与反应导致产品不纯,所以在实验操作①前应增加一步操作,该操作是 。
(5)实验经改进后可制得较纯亚硝酸钠,下列说法正确的是 。
a.亚硝酸钠有咸味,可代替食盐食用
b.常温下,0.1mol/L亚硝酸溶液pH>1
c.已知亚硝酸电离平衡常数为Ka;亚硝酸根水解常数为Kh;水的离子积为Kw;则三者关系为:Ka·Kh=Kw
d.0.1mol/L亚硝酸钠溶液中存在:c(NO2-)>c(Na+)>c(OH-)>c(H+)
【答案】(1)C+4HNO3(浓)![]() CO2↑+4NO2↑+2H2O;(2)溶液变蓝,铜片溶解,无色气体冒出;除去未反应的NO,防止污染空气(3)将生成物置于试管中,加入稀硫酸,若产生无色气体并在液面上方变为红棕色,则D中产物是亚硝酸钠。(反应的离子方程式是3NO2-+2H+=NO3-+2NO↑+H2O)或者:将生成物置于试管中,加入酸性KMnO4溶液,若无气泡产生,溶液紫色褪去,则D中产物是亚硝酸钠,(反应的离子方程式是5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O)a.2CO2+2Na2O2===2Na2CO3+O2,碱石灰(1分)b.打开弹簧夹,通入N2一段时间(5)bc
CO2↑+4NO2↑+2H2O;(2)溶液变蓝,铜片溶解,无色气体冒出;除去未反应的NO,防止污染空气(3)将生成物置于试管中,加入稀硫酸,若产生无色气体并在液面上方变为红棕色,则D中产物是亚硝酸钠。(反应的离子方程式是3NO2-+2H+=NO3-+2NO↑+H2O)或者:将生成物置于试管中,加入酸性KMnO4溶液,若无气泡产生,溶液紫色褪去,则D中产物是亚硝酸钠,(反应的离子方程式是5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O)a.2CO2+2Na2O2===2Na2CO3+O2,碱石灰(1分)b.打开弹簧夹,通入N2一段时间(5)bc


实验室用图示装置制备KClO溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4。

<查阅资料>Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3;
K2FeO4易溶于水,微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。
(1)仪器a的名称: ;装置C中三颈瓶置于冰水浴中的目的是 。
(2)装置B吸收的气体是 ,装置D的作用是 。
(3)C中得到足量KClO后,将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为 。再加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品。
(4)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,其提纯步骤为:
①将一定量的K2FeO4粗产品溶于冷的3 mol/L KOH溶液中。
②过滤。
③ 。
④搅拌、静置、过滤,用乙醇洗涤2~3次。
⑤在真空干燥箱中干燥。
(5)称取提纯后的K2FeO4样品0.2200 g于烧杯中,加入强碱性亚铬酸盐溶液,反应后再加稀硫酸调节溶液呈强酸性,配成250 mL溶液,取出25.00 mL放入锥形瓶,用0.01000 mol/L的(NH4)2Fe(SO4)2溶液滴定至终点,重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液30.00 mL。涉及主要反应为:
Cr(OH)4-+FeO42- = Fe(OH)3↓+CrO42-+OH-
2CrO42-+2H+![]() Cr2O72-+H2O
Cr2O72-+H2O
Cr2O72-+6Fe2++14H+ = 6Fe3++2Cr3++7H2O
则该K2FeO4样品的纯度为 。
【答案】(1)分液漏斗; 防止Cl2与KOH反应生成KClO3;
(2)HCl 吸收Cl2,防止污染空气;
(3)3ClO-+2Fe3++10OH-==2FeO42-+3Cl-+5H2O;
(4)将滤液置于冰水浴中,向滤液中加入饱和KOH溶液;(5)90% ;
 考点:考查了实验制备、滴定原理的相关知识.
考点:考查了实验制备、滴定原理的相关知识.
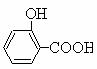
Ⅰ.制备水杨酸对正辛基苯基酯(![]() )的过程如下:
)的过程如下:
步骤一:将水杨酸晶体投入到三颈烧瓶中,再加入适量的氯苯作溶剂并充分搅拌使晶体完全溶解,最后加入少量的无水三氯化铝。
步骤二:按下图所示装置装配好仪器,水浴加热控制温度在20~40℃之间,在搅拌下滴加SOCl2,反应制得水杨酰氯。该反应方程式为:
 (水杨酸)+SOCl2→
(水杨酸)+SOCl2→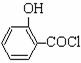 (水杨酰氯)+HCl↑+SO2↑
(水杨酰氯)+HCl↑+SO2↑
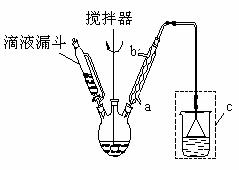
步骤三:将三颈烧瓶中混合液升温至80℃,再加入对正辛苯酚![]() ],温度控制在100℃左右,不断搅拌。
],温度控制在100℃左右,不断搅拌。
步骤四:过滤、蒸馏、减压过滤;酒精洗涤、干燥即得产品。
(1)实验时,冷凝管中的冷却水进口为 _______(选填“a”或“b”);
(2)步骤一中加入无水三氯化铝的作用是 ________________________________。
(3)步骤三中发生反应的化学方程式为 __________________________________。.
Ⅱ.PCl3可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
| 熔点/℃ | 沸点/℃ | 密度/g·mL-1 | 其他 | |
| 白磷 | 44.1 | 280.5 | 1.82 | 2P(过量)+3Cl2 |
| PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于PCl3 |
已知下图是实验室制备PCl3的装置(部分仪器已省略),则:
(1)实验室制备Cl2的离子反应方程式为:________________。
(2)碱石灰的作用除了防止空气中的O2和水蒸气进入并与产品发生反应外还有:_________。
(3)向仪器甲中通入干燥Cl2之前,应先通入一段时间的干燥CO2,其目的是_____________。
(4)测定产品中PCl3纯度的方法如下:迅速称取m g产品,水解完全后配成500mL溶液,取出25.00mL加入过量的c1 mol/L V1 mL 碘溶液,充分反应后再用c2 mol/L Na2S2O3溶液滴定过量的碘,终点时消耗V2 mL Na2S2O3溶液。已知:H3PO3+H2O+I2==H3PO4+2HI;I2+2Na2S2O3==2NaI+Na2S4O6;假设测定过程中没有其他反应,则根据上述数据,求出该产品中PCl3的质量分数为 _______(用含字母的代数式表示、可不化简)。
【答案】a催化剂![]() +
+![]()
![]()
![]() +HCl↑MnO2+4H++2Cl—
+HCl↑MnO2+4H++2Cl—![]() Mn2++2H2O+Cl2↑吸收多余氯气,避免污染环境排尽装置中空气,防止其中的O2和水蒸气与PCl3反应
Mn2++2H2O+Cl2↑吸收多余氯气,避免污染环境排尽装置中空气,防止其中的O2和水蒸气与PCl3反应![]()

本卷还有3题,登录并加入会员即可免费使用哦~

该作品由: 用户梅菊兰竹分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。