下列实验事实陈述正确并且有因果关系的是 ( )
A.滴加BaC12溶液生成白色沉淀 原溶液中有SO42﹣
B.用洁净铂丝蘸取溶液进行焰色反应:火焰呈黄色 原溶液中有Na+无K+
C.滴加氯水和CC14,振荡、静置.下层溶液显紫色 原溶液中有I﹣
D.滴加几滴稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝 原溶液中无NH4+
【答案】C
【解析】A 滴加BaC12溶液生成白色沉淀 原溶液中有可能含有SO42﹣、CO32-、Cl-等,错误;B 用洁净铂丝蘸取溶液进行焰色反应:火焰呈黄色 原溶液中有Na+但不能确定是否含K+,错误;C 滴加氯水和CC14,振荡、静置.下层溶液显紫色 说四氯化碳溶液中含有I2,则加入氯水时发生了反应:Cl2+2I-=2Cl-+I2,因此可以证明原溶液中有I﹣,正确;D 滴加几滴稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,可能是溶液中不含有NH4+,也可能是溶液浓度小反应产生的NH3∙H2O少,不能形成氨气逸出,因此不能确定原溶液中无NH4+,错误。
已知,某无色溶液中含有下列离子中的几种:Na+、Ba2+、Br-、Cl-、SO32-、SO42-,为了确定溶液的组成,某学生进行如下探究实验:
①用pH试纸检测溶液的酸碱性,溶液的pH大于7
②取少量溶液,向其中滴加氯水,再加入CC14振荡,静置,CC14呈橙黄色
③另取少量溶液,向其中滴加Ba(NO3)2溶液和稀HNO3,有白色沉淀产生
④用分液漏斗将②所得混合液分离,倒出上层清液,滴加AgNO3溶液和稀HNO3,有白色沉淀产生。
根据上述实验判断,下列结论正确的是 ( )
A.原溶液中一定含有Br-、SO42-
B.原溶液一定含有Na+,不含Ba2+
C.实验①与上述离子的检验无关,可以省略
D.若要判断原溶液中是否含有Cl-,所需药品有CCl4溶液、Ba(NO3)2溶液和稀HNO3
【答案】B
【解析】①用pH试纸检测溶液的酸碱性,溶液的pH大于7,即溶液显碱性;②取少量溶液,向其中滴加氯水,再加入CC14振荡,静置,CC14呈橙黄色,说明有单质溴产生,所以黑烟溴离子;③另取少量溶液,向其中滴加Ba(NO3)2溶液和稀HNO3,有白色沉淀产生,则SO32-、SO42-至少含有一种,所以一定不存在钡离子;④用分液漏斗将②所得混合液分离,倒出上层清液,滴加AgNO3溶液和稀HNO3,有白色沉淀产生,白色沉淀是氯化银,由于加入了氯水,所以不能确定原溶液中是否含有氯离子。根据溶液的电中性可知一定存在钠离子,根据以上分析可知原溶液中一定存在Br-、Na+,Ba2+一定不存在,SO32-、SO42-至少含有一种,氯离子不能确定,则A、原溶液中一定含有Br-、Na+,A错误;B、原溶液一定含有Na+,不含Ba2+,B正确;C、实验①与上述离子的检验有关,不能省略,因为如果显酸性,则亚硫酸根就不能存在,C错误;D、若要判断原溶液中是否含有Cl-,首先利用Ba(NO3)2溶液除去SO32-、SO42-,然后再检验,则所需药品有硝酸银溶液、Ba(NO3)2溶液和稀HNO3,D错误,答案选B。
甲、乙、丙、丁是由H+、Na+、Al3+、Ba2+、OH—、Cl—、HCO3—离子中的两种组成,可以发生如图转化,下列说法不正确的是 ( )


A.在甲中滴加丁可能发生反应:HCO3—+ Ba2++OH—= BaCO3↓+ H2O
B.溶液丙中还可以大量共存的离子有:I—、NO3—、SO42—
C.白色沉淀A可能溶解在溶液D中
D.甲为NaHCO3,乙为 AlCl3
【答案】B
【解析】根据题意及物质间的关系可知:甲为NaHCO3;乙为AlCl3;丙为HCl;丁为Ba(OH)2;白色沉淀A是Al(OH)3 ;无色气体B是CO2;白色沉淀C是BaCO3;无色溶液D是Na2CO3 或NaOH,发生的反应为甲+乙:AlCl3+3NaHCO3=3NaCl+Al(OH)3↓+CO2↑;甲+丙HCl+NaHCO3=NaCl+H2O+CO2↑;甲+丁:Ba(OH)2+2NaHCO3= BaCO3↓+ Na2CO3+ 2H2O,据此解答。向碳酸氢钠溶液中滴加过量的Ba(OH)2溶液,根据“以少定多”的原则,离子方程式为HCO3—+ Ba2++OH—= BaCO3↓+ H2O,A项正确;丙为HCl,在酸性溶液在I-、NO3—因发生氧化还原反应而不能大量共存,B项错误;白色沉淀A为Al(OH)3 ,D可能为NaOH,Al(OH)3与强碱反应,C项正确;D.根据上述分析,甲为NaHCO3,乙为 AlCl3,D项正确;答案选B。
某溶液中可能含有OH—、CO32—、AlO2—、SiO32—、SO42—、HCO3—、Na+、Fe3+、Mg2+、Al3+ 等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化如下图所示。下列说法正确的是 ( )
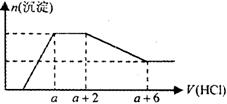 A.原溶液中一定含有Na2SO4
A.原溶液中一定含有Na2SO4
B.反应最后形成的溶液中的溶质只有NaCl
C.原溶液中一定含有的阴离子是:
OH—、SiO32—、AlO2—、CO32—
D.原溶液中含有CO32- 与AlO2- 的物质的量之比为1∶2
【答案】C
【解析】根据与盐酸反应的图像判断,产生的沉淀部分溶解,说明产生的沉淀中有氢氧化物沉淀,可溶于盐酸,该溶液中与HCl反应产生沉淀的离子只有AlO2—、SiO32—,产生的沉淀是氢氧化铝和硅酸沉淀,硅酸不溶于稀盐酸,符合题意,则原溶液中一定含有AlO2—、SiO32—;则与偏铝酸根离子发生水解相互促进的离子Fe3+、Mg2+、Al3+ 均不存在,HCO3—与偏铝酸根离子不能大量共存,因此溶液中的阳离子只有Na+;开始加入稀盐酸无沉淀产生,说明溶液中一定存在OH-;沉淀达到最大值时,再加入稀盐酸,沉淀量保持不变,此时只有碳酸根离子与盐酸反应,所以溶液中还应存在CO32-;硫酸根离子不能确定。A、因为硫酸根离子不能确定,所以不一定含有硫酸钠,A错误;B、最后生成的溶液一定含有氯化钠。可能含有硫酸钠,B错误;C、该溶液中一定存在的阴离子是OH—、SiO32—、AlO2—、CO32—,C正确;D、根据CO32-+2H+=CO2↑+H2O,消耗盐酸的体积是a+2-a=2,所以碳酸根离子的物质的量是1mol,根据Al(OH)3+H+=Al3++2H2O,溶解氢氧化铝消耗的盐酸的体积是a+6-a-2=4,根据Al元素守恒,则溶液中偏铝酸根离子的物质的量是4mol,所以原溶液中含有CO32- 与AlO2- 的物质的量之比为1∶4,D错误,答案选C。
某无色溶液中只可能含有Na+ 、Ba2 +、Mg2+、Cl一、Br一、SO32一、SO42一,对该溶液进行下列实验,实验操作和现象如下表:
| 步骤 | 操 作 | 现 象 |
| (1) | 取少量溶液滴加几滴石蕊试液 | 溶液变蓝 |
| (2) | 另取少量溶液滴加过量氯水,再加入CCl4振荡,静置 | 上层无色,下层呈橙红色 |
| (3) | 取(2)上层溶液,加入过量Ba(NO3)2溶液和稀HNO3,过滤 | 有白色沉淀产生 |
| (4) | 向(3)的滤液中加入过量AgNO3溶液和稀HNO3 | 有白色沉淀产生 |
下列结论正确的是 ( )
A.可能含有 Cl一、Mg2+、SO42一 B.肯定含有 Na+、Br-、SO32-
C.肯定没有 Ba2+、Br-、Cl- D.不能确定 Mg2+ 、SO32-、SO42-
【答案】B
【解析】(1)取少量溶液滴加几滴石蕊试液,溶液变蓝,说明溶液呈碱性,由于离子组中没有OH- 离子,说明含强弱弱酸盐的弱酸根离子,应含有SO32-离子,水解呈碱性,SO32-离子和Ba2+、Mg2+离子生成BaSO3 、MgSO3沉淀,不能大量共存,则一定没有Ba2+、Mg2+离子,根据溶液电中性,溶液中一定含有Na+离子;(2)另取少量溶液滴加过量氯水,再加入CCl4 振荡,静置,上层无色,下层呈橙红色,说明溶液中含有Br-离子; (3)取(2)上层溶液,加入过量Ba(NO3)2溶液和稀HNO3 ,过滤,有白色沉淀产生,生成的沉淀为BaSO4 ,由于加入的氯水有强的氧化性,会将原溶液中的SO32-离子氧化为SO4 2- 离子,因此不能说明原溶液中是否含有SO4 2- 离子;(4)向(3)的滤液中加入过量AgNO3 溶液和稀HNO3 ,有白色沉淀产生,该沉淀为AgCl,因第(2)步操作加入;氯水中引入Cl-离子,因此不能说明溶液中含有Cl-离子。综上所述可知,在原溶液中一定含有Na+、Br-、SO32-,一定不含有Ba2+、Mg2+离子,不能确定的离子是SO4 2- 、Cl-离子。故选项B正确。
本卷还有9题,登录并加入会员即可免费使用哦~

该作品由: 用户小小分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。