下列叙述不正确的是 ( )
A.漂白粉的有效成分是Ca(ClO)2 B.胆矾的成分是CuSO4·5H2O
C.医疗上用的“钡餐”成分是BaSO4 D.光导纤维主要成分是Si
【答案】D
【解析】光导纤维主要成分是SiO2而不是单质Si。
【考点】物质的组成、性质和分类——重要无机物的组成和用途
用NA表示阿伏加德罗常数。下列说法中,正确的是 ( )
A.1.8g重水(D2O)中含有的质子数为1.0 NA
B.500℃、30MPa下:N2(g)+3H2(g)![]() 2NH3(g);△H=-38.6kJ·mol-1;将1.5NA的H2和过量N2在此条件下充分反应,放出热量19.3kJ
2NH3(g);△H=-38.6kJ·mol-1;将1.5NA的H2和过量N2在此条件下充分反应,放出热量19.3kJ
C.标准状况下,11.2 L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA
D.60 g石英晶体中含有的Si-O键数目为2NA
【答案】C
【解析】重水的摩尔质量为20 g·mol-1,一个重水分子中含有10个质子,故1.8g重水中含有的质子数为1.8×10×NA /20=0.9NA,故A错。可逆反应中的反应热表示该反应完全进行到底时的热效应,由于1.5mol的H2在合成氨反应中不可能完全完全转化,因此放出的热量必小于19.3kJ,故B错。由于SiO2是呈空间网状的正四面体结构,60 g石英相当于1molSiO2,含有的Si-O键数目应为4NA,故D错。
【考点】化学用语及常用计量——阿氏常数
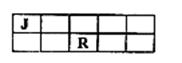
J、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右下表。已知:J元素最低负化合价的绝对值与其原子最外层电子数相等,M是地壳中含量最多的金属元素。下列说法错误的是 ( )
A.J和氢组成的化合物分子中只含有极性共价键
B.工业上用电解熔融的M的氧化物方法来制备M
C.R、T两元素的气态氢化物中,T的气态氢化物更稳定
D.J、M、R、T元素最高价氧化物对应的水化物中酸性最强的是HTO4
【答案】A
【解析】已知四种元素均是短周期元素,故J必为第二周期元素,由于J元素最低负化合价的绝对值与其原子最外层电子数相等,故J为第二周期第IVA元素碳,由此可知R为S,考虑到J、M、R、T是原子序数依次增大的短周期主族元素,故T必为Cl。由M是地壳中含量最多的金属元素,故M为Al。对于选项A,考试到碳和氢可组成种类繁多的烃类,如C2H4、C2H6等,它们的分子中既存在极性键又存在非极性键,故A错。
【考点】物质结构 元素周期律——“位——构——性”的综合考查
下列化学原理表述正确的是 ( )
A.氢硫酸溶液加水稀释,电离程度增大,H+浓度增大
B.Na2CO3溶液中满足:c(Na+)=2c(CO32-)+2 c(HCO3-)+ 2c(H2CO3)
C.NaHCO3溶液不显中性的原因:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
D.同体积同pH的盐酸和醋酸,与足量的锌反应,盐酸的反应速率快,生成H2的物质的量多
【答案】B
【解析】氢硫酸溶液加水稀释,电离程度增大,但c(H+)会变小,A错。选项B是Na2CO3溶液中的物料守恒式,正确。根据所学知识可知NaHCO3溶液显碱性,说明NaHCO3的水解程度大于电离程度,因此不显中性的原因应用水解方程式表示,而不应用电离方程式表示,C错。由于醋酸是弱酸,故同体积同pH的盐酸和醋酸,醋酸所能提供的n(H+)的多,在反应过程中醋酸的反应速率快,生成H2的物质的量也多,D错。
【考点】电解质溶液——弱电解质的电离与水解
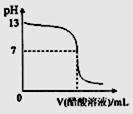 常温下,向10mL 0.1 mol·L-1NaOH溶液中逐滴加入0.1 mol·L-1醋酸溶液,所得滴定曲线如下图所示。下列说法正确的是 ( )
常温下,向10mL 0.1 mol·L-1NaOH溶液中逐滴加入0.1 mol·L-1醋酸溶液,所得滴定曲线如下图所示。下列说法正确的是 ( )
A.pH=7时,所加醋酸溶液的体积为10mL
B.pH<7时,溶液中:c(CH3COO-)>c(Na+)
C.7<pH<13时,溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.继续滴加0.1 mol·L-1醋酸溶液,溶液pH可以变为1
【答案】B
【解析】当NaOH溶液和醋酸恰好完全反应时,生成醋酸钠水解而使溶液显碱性,故A错。当pH<7时有c(H+)>c(OH-),根据电荷守恒可得c(CH3COO-)>c(Na+),故B正确。当7<pH<13时,溶液也有c(Na+)> c(OH-)> c(CH3COO-)>c(H+)这一种情况,C错。对于选项D可作一极端设想,若溶液就是0.1 mol·L-1醋酸,由于醋酸是弱酸,溶液的pH也大于1,故D也错。
【考点】电解质溶液——离子浓度的大小比较
本卷还有8题,登录并加入会员即可免费使用哦~

该作品由: 用户JBY分享上传
可圈可点是一个信息分享及获取的平台。不确保部分用户上传资料的来源及知识产权归属。如您发现相关资料侵犯您的合法权益,请联系 可圈可点 ,我们核实后将及时进行处理。