氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:


已知:①菱锰矿石主要成分是![]() ,还含有少量Fe、Al、Ca、Mg等元素;
,还含有少量Fe、Al、Ca、Mg等元素;
②相关金属离子![]()
![]() 形成氯氧化物沉淀时的pH如下:
形成氯氧化物沉淀时的pH如下:
| 金属离子 | Al3+ | Fe3+ | Fe2+ | Ca2+ | Mn2+ | Mg2+ |
| 开始沉淀的pH | 3.8 | 1.5 | 6.3 | 10.6 | 8.8 | 9.6 |
| 沉淀完全的pH | 5.2 | 2.8 | 8.3 | 12.6 | 10.8 | 11.6 |
③常温下,![]()
![]() 的溶度积分别为
的溶度积分别为![]()
![]()
回答下列问题:
(1)“焙烧”时发生的主要化学反应方程式为_____________________。
(2)分析下列图1、图2、图3,氯化铵焙烧菱镁矿的最佳条件是:
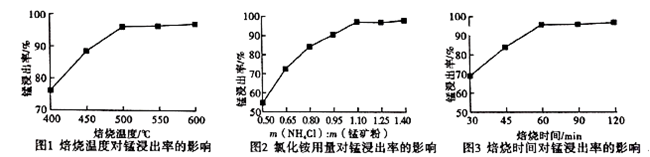

焙烧温度_________,氯化铵与菱镁矿粉的质量之比为__________,焙烧时间为___________.
(3)浸出液“净化除杂”过程如下:首先加入![]()
![]() 氧化为
氧化为![]() ,反应的离子方程式为________;然后调节溶液pH使
,反应的离子方程式为________;然后调节溶液pH使![]() 沉淀完全,此时溶液的pH范围为____。再加入
沉淀完全,此时溶液的pH范围为____。再加入![]() 沉淀
沉淀![]()
![]() ,当
,当![]()
![]() 时,
时, ![]() =______
=______![]()
(4)碳化结晶时,发生反应的离子方程式为___________。
(5)流程中能循环利用的固态物质是____________。
【答案】MnCO3+2NH4Cl![]() MnCl2+2NH3↑+CO2↑+H2O 500℃ 1.10 60min MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O 5.2≤pH<8.8 5×10-6 Mn2++2HCO3-
MnCl2+2NH3↑+CO2↑+H2O 500℃ 1.10 60min MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O 5.2≤pH<8.8 5×10-6 Mn2++2HCO3-![]() MnCO3↓+CO2↑+H2O NH4Cl
MnCO3↓+CO2↑+H2O NH4Cl
【解析】 (1)根据工艺流程图知“焙烧”时发生的主要化学反应方程式为:MnCO3+2NH4Cl![]() MnCl2+2NH3↑+CO2↑+H2O;
MnCl2+2NH3↑+CO2↑+H2O;
(2)根据图示锰浸出率比较高,焙烧菱镁矿的最佳条件是:焙烧温度500℃;氯化铵与菱镁矿粉的质量比为1.10;焙烧时间为60min;
(3)二氧化锰具有氧化性,可以氧化亚铁离子,而二氧化锰被还原为锰离子,反应的离子方程式为:MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;根据题干信息知pH在5.2时Al3+沉淀完全,pH在8.8时,Mn2+开始沉淀,所以将Fe3+、Al3+沉淀完全,可以调整pH范围在5.2≤pH<8.8;根据![]()
![]() 的溶度积计算得:c2(F-)=
的溶度积计算得:c2(F-)=![]()
![]() ,c(Mg2+)=
,c(Mg2+)=![]()
![]() mol/L;
mol/L;
(4)根据流程图知碳化结晶时,发生反应的离子方程式为:Mn2++2HCO3-![]() MnCO3↓+CO2↑+H2O;
MnCO3↓+CO2↑+H2O;
(5)流程图可以看出能循环利用的固态物质是NH4Cl。
水是一种极弱的电解质,可以发生微弱电离,电离方程式为:H2O
 H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L 注:水的电离是永恒存在的,不研究水溶液的体系中均存在水的电离平衡,不要忽略H+和OH-共同存在。
 H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L
H++OH-。25℃时,水电离出来的c(H+)=c(OH-)=10-7mol/L 注:水的电离是永恒存在的,不研究水溶液的体系中均存在水的电离平衡,不要忽略H+和OH-共同存在。
2、掌握水的电离平衡状态的特征。
3、掌握影响水的电离平衡的因素。
课时要求:10
考试频率:必考
分值比重:2